|
Всеукраїнський Турнір Юних Хіміків
| |
| ovsanka | Дата: Понедельник, 17.09.2012, 08:45 | Сообщение # 16 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| 3.Дезинфе́кция — это комплекс мероприятий, направленных на уничтожение возбудителей инфекционных заболеваний и разрушение токсинов на объектах внешней среды. Для её проведения обычно используются химические вещества, например, формальдегид или гипохлорит натрия, растворы органических веществ, обладающих дезинфицирующими свойствами: хлоргексидин, ЧАСы, надуксусная кислота. Дезинфекция уменьшает количество микроорганизмов до приемлемого уровня, но полностью может их и не уничтожить. Является одним из видов обеззараживания. Различают профилактическую, текущую и заключительную дезинфекцию:
Вода – второй по важности природный ресурс (после воздуха). В наше время вода – стратегический ресурс, борьба за который в будущем может даже перерасти в войны. В то время как передовые страны мира начинают испытывать дефицит воды, наши горожане совсем скоро все будут обеспечены круглосуточной, качественной водой.
http://www.water.kherson.ua/index.php/interesnoe-o-vode.html
Бесхлорные технологии очистки воды http://premium-aqua.kiev.ua/?gclid=COa2mb_xu7ICFYHwzAodo2oAWA
Очистка сточных вод http://ru.wikipedia.org/wiki/Очистка_сточных_вод
ОЧИСТКА ВОДЫ - ОСНОВНЫЕ ПОНЯТИЯ
Хлорирование воды
В практике обеззараживания питьевой воды имеются несколько наиболее распространенных методов: хлорирование, озонирование, ультрафиолетовая обработка и пр. Хлорирование является одним из самых дешевых и в то же время эффективных методов. В нашей стране повсеместно распространен метод хлорирования воды.
Наиболее важной проблемой данного метода является высокая активность хлора, он вступает в химические реакции со всеми органическими и неорганическими веществами находящимися в воде. В воде из поверхностных источников (которые в основном являются источниками водозабора) находится огромное количество сложных органических веществ природного происхождения, а также в большинстве крупных промышленных городов в воду попадают с промышленными стоками красители, ПАВ, нефтепродукты, фенолы и пр.
При хлорировании воды, содержащей вышеприведенные вещества, образуются ХЛОРСОДЕРЖАЩИЕ ТОКСИНЫ, МУТАГЕННЫЕ И КАНЦЕРОГЕННЫЕ ВЕЩЕСТВА, В ТОМ ЧИСЛЕ ДИОКСИДЫ.
При обработке воды активным хлором образуются особо опасные вещества:
Хлороформ, обладающий канцерогенной активностью
Дихлорбромметан, хлоридбромметан, трибромметан, обладающие МУТАГЕННЫМИ СВОЙСТВАМИ
2,4,6-трихлорфенол, 2-хлорфенол, дихлорацетонитрил, хлоргиередин, полихлорированные бифенилы, являющиеся иммунотоксичными и канцерогенными
Тригалогенметаны, канцерогенные соединения хлора.
Данные вещества оказывают замедленное убийственное воздействие на организм человека. Многие очищают только питьевую воду, НО НЕ СТОИТ ЗАБЫВАТЬ, ЧТО БОЛЬШИНСТВО КАНЦЕРОГЕННЫХ И МУТАГЕННЫХ ХЛОРОРГАНИЧЕСКИХ ВЕЩЕСТВ ПОПАДАЮТ В НАШ ОРГАНИЗМ ПРИ КУПАНИИ И МЫТЬЕ ТЕЛА. По ориентировочным данным, влияния на организм человека хлорорганических веществ следующее: ЧАСОВОЕ ПРИНЯТИЕ ВАННЫ РАВНО 10 ЛИТРАМ ВЫПИТОЙ ХЛОРИРОВАННОЙ ВОДЫ.
Ряд онкоэпидемиологических исследований, проведенных, США и Германией, позволяет предположить существование взаимосвязи между заболеваемостью населения отдельными формами раковых заболеваний и содержанием в питьевой воде хлорорганических соединений, и прежде всего встречающегося наиболее часто и в наибольшей концентрации - хлороформа.
В США получены данные, свидетельствующие о наличии статистически достоверной связи между концентрацией хлорорганики в питьевой воде и частотой случаев заболевания и смертности от рака мочевого пузыря, кожи, желудочно-кишечного тракта и других органов.
В ряде развитых стран уже установлены предельно допустимые концентрации суммы тригалогенметанов, также многие развитые страны уходят от хлорирования питьевой воды, переходя на более естественные, экологические и безопасные способы обеззараживания воды.
Но, не все так страшно как звучит на первый взгляд. Данная проблема является в большей степени глобальной проблемой водоснабжения городов.
В квартире или коттедже решить проблему очистки воды от хлора и хлорорганических веществ возможно с помощью адсорбционного угольного фильтра, который при надлежащем обслуживании и своевременной замене угля будет служить Вашим надежным защитником, но только от хлора, других загрязнений он не уберет! http://voda-aquel.mirtesen.ru/blog....NYATIYA
Экологи признали непригодными для питья более 60% украинской воды 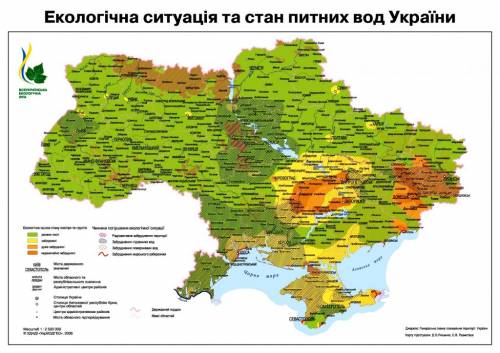 http://voda-aquel.mirtesen.ru/photos/20864076320 http://voda-aquel.mirtesen.ru/photos/20864076320
ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Понедельник, 17.09.2012, 08:47 | Сообщение # 17 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| 3.Химический анализ воды. Нормативы http://www.aquafilter.ru/water/norma.htm
ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Понедельник, 17.09.2012, 20:40 | Сообщение # 18 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| 5.
Конструкционные материалы, материалы, из которых изготовляются детали конструкций (машин и сооружений), воспринимающих силовую нагрузку. Определяющими параметрами Конструкционные материалы являются механические свойства, что отличает их от других технических материалов (оптических, изоляционных, смазочных, лакокрасочных, декоративных, абразивных и др.). К основным критериям качества Конструкционные материалы относятся параметры сопротивления внешним нагрузкам: прочность, вязкость, надежность, ресурс и др. Длительный период в своём развитии человеческое общество использовало для своих нужд (орудия труда и охоты, утварь, украшения и др.) ограниченный круг материалов: дерево, камень, волокна растительного и животного происхождения, обожжённую глину, стекло, бронзу, железо. Промышленный переворот 18 в. и дальнейшее развитие техники, особенно создание паровых машин и появление в конце 19 в. двигателей внутреннего сгорания, электрических машин и автомобилей, усложнили и дифференцировали требования к материалам их деталей, которые стали работать при сложных знакопеременных нагрузках, повышенных температурах и др. Основой Конструкционные материалы стали металлические сплавы на основе железа (чугуны и стали), меди (бронзы и латуни), свинца и олова.
При конструировании самолётов, когда главным требованием, предъявляемым к Конструкционные материалы, стала высокая удельная прочность, широкое распространение получили древесные пластики (фанера), малолегированные стали, алюминиевые и магниевые сплавы. Дальнейшее развитие авиационной техники потребовало создания новых жаропрочных сплавов на никелевой и кобальтовой основах, сталей, титановых, алюминиевых, магниевых сплавов, пригодных для длительной работы при высоких температурах. Совершенствование техники на каждом этапе развития предъявляло новые, непрерывно усложнявшиеся требования к Конструкционные материалы (температурная стойкость, износостойкость, электрическая проводимость и др.). Например, судостроению необходимы стали и сплавы с хорошей свариваемостью и высокой коррозионной стойкостью, а химическому машиностроению — с высокой и длительной стойкостью в агрессивных средах. Развитие атомной энергетики связано с применением Конструкционные материалы, обладающих не только достаточной прочностью и высокой коррозионной стойкостью в различных теплоносителях, но и удовлетворяющих новому требованию — малому поперечному сечению захвата нейтронов.
Конструкционные материалы подразделяются: по природе материалов — на металлические, неметаллические и композиционные материалы, сочетающие положительные свойства тех и др. материалов; по технологическому исполнению — на деформированные (прокат, поковки, штамповки, прессованные профили и др.), литые, спекаемые, формуемые, склеиваемые, свариваемые (плавлением, взрывом, диффузионным сращиванием и т.п.); по условиям работы — на работающие при низких температурах, жаропрочные, коррозионно-, окалино-, износо-, топливо-, маслостойкие и т.д.; по критериям прочности — на материалы малой и средней прочности с большим запасом пластичности, высокопрочные с умеренным запасом пластичности.
http://bse.sci-lib.com/article064053.html
Производство минеральных удобрений является крупнейшей подотраслью химической промышленности. Это одна из наиболее прибыльных и финансово-устойчивых отраслей не только в химическом комплексе, но и в промышленности в целом.
Удобрения — вещества, применяемые для улучшения питания растений, свойств почвы, повышения урожаев. Их эффект обусловлен тем, что данные вещества предоставляют растениям один или несколько дефицитных химических компонентов необходимых для их нормального роста и развития.
Классификация удобрений
Удобрения можно классифицировать по следующим признакам:
по происхождению (минеральные и органические);
по агрегатному состоянию (жидкие, полужидкие, твёрдые);
по способу действия (прямого и косвенного);
по способу их внесения в почву
основное, припосевное, подкормочное
внутри почвенное, поверхностное
[править]
Минеральные удобрения
Динамика производства минеральных удобрений в России в 1992—2008 годах, в млн тонн
Согласно данным Росстата сельскохозяйственными предприятиями минеральных удобрений внесено в пересчете на 100% питательных веществ, Российская Федерация, значение показателя за год 1990 -9,9 млн. т, 2010 -1,9 млн. т Таким образом, в нашей стране масштабы применения минеральных удобрений на полях за последние 20 лет сократились более чем в 5 раз.
Минеральные удобрения вносятся для пополнения запаса питательных веществ в почве, таких как фосфор (P), калий (К), азот (N). Если эти удобрения вносятся отдельно — их называют простыми (аммиачная селитра (N), суперфосфат (P), хлористый калий (K)). При внесении могут использоваться смеси удобрений, но это значительно усложняет подготовку к внесению и ухудшает качество их распределения по полю. Поэтому широкое распространение получили сложные удобрения (нитрофоски (фосфор, азот и калий) и аммофос (фосфор и азот)).
[править]
Азотные удобрения
Выпускаются в трех видах: аммиачные (сульфат аммония), нитратные(аммиачная селитра), амидные (мочевина). Формы азота определяют сроки и технику внесения удобрения. Аммиачный азот значительно легче поглощается корнями при слабой кислотности почвы, на некоторое время закрепляется в ней. Его можно вносить как весной, так и поздней осенью. Нитратный азот почвой не закрепляется, находится в ней в виде раствора. Поэтому такое удобрение можно вносить только в период с ранней весны до середины лета. Это удобрение легко поглощается растениями и хорошо подходит для летних подкормок. К амидным удобрениям относится мочевина. Азот этого удобрения быстро (особенно при повышенных температурах) переходит в аммиачную форму. Это удобрение быстродействующее. Используется для подкормок, слабо подкисляет почву.
[править]
Фосфорные удобрения
По степени растворимости: водорастворимые (суперфосфат простой и двойной); полурастворимые — не растворяются в воде, но растворяются в слабых кислотах (преципитат); труднорастворимые в воде, но растворимые в слабых кислотах (фосфоритная мука). Водорастворимые применяют на любых почвах. При этом тщательно перемешивать с водой их не обязательно. Полурастворимые и труднорастворимые вносят преимущественно на кислых почвах. Они становятся доступными растениям лишь после воздействия на них кислотности почвы. Вносят их заблаговременно, стараясь перемешать с почвой.
[править]
Калийные удобрения
В качестве минеральных удобрений применяются концентрированные хлористые (хлористый калий) и сернокислые (калийная соль) соли. Все они хорошо растворимы в воде. Калий довольно медленно проникает в глубь почвы, но все же быстрей чем фосфор. На глинистых и суглинистых почвах калийные удобрения надо вносить в те слои почвы, где развивается основная масса мелких корней, чтобы обеспечить быстрое поступление в них калия. На песчаных почвах калия меньше, чем на глинистых, поэтому потребность в калийных удобрениях здесь выше. На легких и торфяных почвах внесение калийных удобрений с осени нежелательно из-за вымывания калия.
[править]
Хлористые удобрения
Сера, входящая в состав сернокислых удобрений, — элемент, необходимый растению. Хлор же не нужен. Хлористые удобрения поэтому лучше вносить с осени в повышенных дозах. Осенними дождями и весенними водами входящий в их состав хлор вымывается в глубокие слои почвы и не вредит растениям. В небольших дозах эти удобрения можно вносить и весной.
[править]
Микроудобрения (удобрения содержащие бор, марганец, цинк, медь, молибден и др.)
Основная статья: Микроудобрения
При использовании микроудобрений большое значение имеет точное установление доз, так как не только недостаток, но и их избыток вреден для растений. Правильное применение микроудобрений предохраняет растения от некоторых заболеваний (пробковая пятнистость яблок, розеточная болезнь и др.), влияет на их рост и развитие, на завязывание плодов (усиливает процессы оплодотворения, плодообразования), урожайность и качество плодов.
В качестве микроудобрений используют чистые химические соли, которые можно приобрести в магазинах, рынках. Кроме того, промышленность выпускает простые и комплексные удобрения, включающие ряд отдельных микроэлементов: суперфосфат с бором, марганцем; аммофос с цинком и др.
В практике плодоводства давно установлена возможность введения в плодовые растения ряда элементов минерального питания непосредственно через листья. Такое некорневое питание действует быстрее, чем соответственное удобрение, внесенное в почву, хотя и менее продолжительно. Лучшим способом снабжения плодовых деревьев микроэлементами является опрыскивание их растворами соответствующих солей. Такое опрыскивание лучше всего проводить вечером, в пасмурную погоду, чтобы раствор не высох до того, как впитается листьями (см.пункт «Некорневые подкормки»).
[править]
Простые удобрения
азотные
фосфорные
калийные
известковые
Минера́льные удобре́ния — неорганические соединения, содержащие необходимые для растений элементы питания.
Минеральные удобрения содержат питательные вещества в виде различных минеральных солей. В зависимости от того, какие питательные элементы содержатся в них, удобрения подразделяют на простые и комплексные. Простые (односторонние) удобрения содержат один какой-либо элемент питания. К ним относятся фосфорные, азотные, калийные и микроудобрения. Комплексные, или многосторонние, удобрения содержат одновременно два или более основных питательных элемента.
В почвах обычно имеются все необходимые растению питательные элементы. Но часто отдельных элементов бывает недостаточно для удовлетворительного роста растений. На песчаных почвах растения нередко испытывают недостаток магния, на торфяных почвах – молибдена, на черноземах – марганца и т. п. Применение минеральных удобрений – один из основных приемов интенсивного земледелия. С помощью удобрений можно резко повысить урожаи любых культур на уже освоенных площадях без дополнительных затрат на обработку новых земель.
Значительную долю в производстве удобрений занимают сложные минеральные удобрения (такие, как аммофос, диаммофос, азофоска и т.п.), отличающиеся от одинарных тем, что содержат два или три питательных вещества. Преимущество сложных удобрений заключается в том, что их состав может меняться в зависимости от требований рынка.
ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Понедельник, 17.09.2012, 20:51 | Сообщение # 19 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| Внутреннее строение Юпитера - пятая планета от Солнца, крупнейшая в Солнечной системе. Наряду с Сатурном, Ураном и Нептуном Юпитер классифицируется как газовый гигант.
Атмосферное давление 20—220 кПа
Состав:
89,8±2,0 % Водород (H2)
10,2±2,0 % Гелий
~0,3 % Метан (CH4)
~0,026 % Аммоний (NH4+)
~0,003 % Дейтерид водорода (HD)
0,0006 % Этан (CH3—CH3)
0,0004 % Вода
Льды:
Аммоний
Вода
Гидросульфид аммония (NH4SH)
Химический состав внутренних слоёв Юпитера невозможно определить современными методами наблюдений, однако обилие элементов во внешних слоях атмосферы известно с относительно высокой точностью, поскольку внешние слои непосредственно исследовались спускаемым аппаратом «Галилео», который был спущен в атмосферу 7 декабря 1995 года. Два основных компонента атмосферы Юпитера — молекулярный водород и гелий. Атмосфера содержит также немало простых соединений, например, воду, метан (CH4), сероводород (H2S), аммиак (NH3) и фосфин (PH3)]. Их количество в глубокой (ниже 10 бар) тропосфере подразумевает, что атмосфера Юпитера богата углеродом, азотом, серой и, возможно, кислородом по фактору 2—4 относительно Солнца.
Другие химические соединения, арсин (AsH3) и герман (GeH4), присутствуют, но в незначительных количествах.
Концентрация инертных газов, аргона, криптона и ксенона, превышает их количество на Солнце (см. таблицу), а концентрация неона явно меньше. Присутствует незначительное количество простых углеводородов: этана, ацетилена и диацетилена, — которые формируются под воздействием солнечной ультрафиолетовой радиации и заряженных частиц, прибывающих из магнитосферы Юпитера. Диоксид углерода, моноксид углерода и вода в верхней части атмосферы, как полагают, своим присутствием обязаны столкновениям с атмосферой Юпитера комет, таких, например, как комета Шумейкеров-Леви 9. Вода не может прибывать из тропосферы, потому что тропопауза, действующая как холодная ловушка, эффективно препятствует поднятию воды до уровня стратосферы[39].
Красноватые вариации цвета Юпитера могут объясняться наличием соединений фосфора (красный фосфор[41]), серы, углерода[42] и, возможно, органики, возникающей благодаря электрическим разрядам в атмосфере[41]. В эксперименте, (довольно тривиально) симулирующем нижние слои атмосферы, проведённом Карлом Саганом, в среде коричневатых толинов был обнаружен 4-кольцовый хризен, a преобладающими для данной смеси являются полициклические ароматические углеводороды с 4 и более бензольными кольцами, реже с меньшим количеством колец. Поскольку цвет может сильно варьироваться, предполагается, что химический состав атмосферы также различен в разных местах. Например, имеются «сухие» и «мокрые» области с разным содержанием водяного пара.
Структура
Модель внутренней структуры Юпитера: под облаками — слой смеси водорода и гелия толщиной около 21 тыс. км с плавным переходом от газообразной к жидкой фазе, затем — слой жидкого и металлического водорода глубиной 30-50 тыс. км. Внутри может находиться твёрдое ядро диаметром около 20 тыс. км[33].
На данный момент наибольшее признание получила следующая модель внутреннего строения Юпитера:
Атмосфера. Её делят на три слоя:
внешний слой, состоящий из водорода;
средний слой, состоящий из водорода (90  и гелия (10 %); и гелия (10 %);
нижний слой, состоящий из водорода, гелия и примесей аммиака, гидросульфата аммония и воды, образующих три слоя облаков:
вверху — облака из оледеневшего аммиака (NH3). Его температура составляет около −145 °C, давление — около 1 атм;
ниже — облака кристаллов гидросульфида аммония (NH4HS);
в самом низу — водяной лёд и, возможно, жидкая водавероятно, имеется в виду — в виде мельчайших капель. Давление в этом слое составляет около 1 атм, температура примерно −130 °C (143 К). Ниже этого уровня планета непрозрачна.
Слой металлического водорода. Температура этого слоя меняется от 6300 до 21 000 К, а давление от 200 до 4000 ГПа.
Каменное ядро.
Построение этой модели основано на синтезе наблюдательных данных, применении законов термодинамики и экстраполяции лабораторных данных о веществе, находящемся под высоким давлением и при высокой температуре. Основные предположения, положенные в её основу:
Юпитер находится в гидродинамическом равновесии
Юпитер находится в термодинамическом равновесии.
Если к этим положениям добавить законы сохранения массы и энергии, получится система основных уравнений.
В рамках этой простой трёхслойной модели чёткой границы между основными слоями не существует, однако и области фазовых переходов невелики. Следовательно, можно сделать допущение, что почти все процессы локализованы, и это позволяет каждый слой рассматривать отдел
Атмосфера
Структура атмосферы Юпитера.
Температура в атмосфере не растёт монотонно. В ней, как и на Земле, можно выделить экзосферу, термосферу, стратосферу, тропопаузу, тропосферу. В самых верхних слоях температура велика; по мере продвижения вглубь давление растёт, а температура падает до тропопаузы; начиная с тропопаузы, и температура, и давление растут по мере продвижения вглубь. В отличие от Земли, на Юпитере нет мезосферы и соответствующей ей мезопаузы.
В термосфере Юпитера происходит довольно много интересных процессов: именно здесь планета теряет излучением значительную часть своего тепла, именно здесь формируются полярные сияния, именно тут формируется ионосфера. За её верхнюю границу взят уровень давления в 1 нбар. Наблюдаемая температура термосферы 800—1000 К, и на данный момент этот фактический материал до сих пор не получил объяснения в рамках современных моделей, так как в них температура не должна быть выше примерно 400 К. Охлаждение Юпитера тоже нетривиальный процесс: трёхатомный ион водорода(H3+), кроме Юпитера найденный только на Земле, вызывает сильную эмиссию в средней инфракрасной части спектра на длинах волн между 3 и 5 мкм.
Согласно непосредственным измерениям спускаемого аппарата, верхний уровень непрозрачных облаков характеризовался давлением в 1 атмосферу и температурой −107 °C; на глубине 146 км — 22 атмосферы, +153 °C. Также «Галилео» обнаружил «тёплые пятна» вдоль экватора. По-видимому, в этих местах слой внешних облаков тонок, и можно видеть более тёплые внутренние области.
Под облаками находится слой глубиной 7—25 тыс. км, в котором водород постепенно изменяет своё состояние от газа к жидкости с увеличением давления и температуры (до 6000 °C). Чёткой границы, отделяющей газообразный водород от жидкого, по-видимому, не существует. Это может выглядеть примерно как непрерывное кипение глобального водородного океана
ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Понедельник, 17.09.2012, 20:55 | Сообщение # 20 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| Давайте разберем состав каждой планеты.
Меркурий — это небольшой горный мир. На этой планете есть несколько затемненных участков и много кратеров, но там отсутствует атмосфера и вода.
Венера — это шар белого цвета с туманными пятнами. Планета почти полностью окутана слоем белых облаков, состоящих не из водяного пара, а из паров соляной кислоты. Под ними располагается атмосфера Венеры, по большей части состоящая из углекислого газа, непригодного для дыхания. Эта атмосфера поглощает солнечное тепло, подобно одеялу, поэтому температура на поверхности Венеры достигает около 500 градусов Цельсия, и из-за этого на этой планете нет жидкой воды.
Марсу дали название «Красная планета» из-за цвета его пустынь. Размерами Марс в два раза меньше Земли и обладает очень тонким слоем атмосферы, которая состоит из углекислого газа, в котором образуются облака. Если отвечать на вопрос «Есть ли жизнь на марсе?» - то на это можно сказать - никаких определенных признаков жизни на Марсе найдено не было. Скорее всего, основная причина в том, что там жуткий холод.
Юпитер является нашему взору как желтоватый шар с цветными полосами облаков, огибающими его по окружности, и большим красным пятном, ясно просматривающимся на фоне облаков. Юпитер – являет собой большой жидкий шар, который состоит по большей части из водорода и гелия. Этот шар становится плотнее к центру планеты.
Состав планеты Сатурн, преимущественно включает в себя жидкий водород и имеет вокруг себя несколько ярких колец, состоящих из множества мелких частиц, которые двигаются по своим орбитам вокруг планеты, наподобие маленьких лун.
Уран тоже, как и Сатурн окружен кольцами, только они намного темнее.
Нептун – планета зеленоватого цвета, довольно тусклая.
Плутон же является самой маленькой планетой Солнечной системы. Орбита у него – в форме эллипса, именно из-за этого он время от времени подходит к Солнцу ближе, чем Нептун. Изучение космоса при помощи спутников и автоматических станций позволяет исследователям узнать больше о каждом элементе нашей Солнечной системы.
ЗРИ В КОРЕНЬ
Сообщение отредактировал ovsanka - Понедельник, 17.09.2012, 20:56
|
|
|
| |
| ovsanka | Дата: Понедельник, 17.09.2012, 20:58 | Сообщение # 21 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| Химический состав атмосферы планеты Венера

ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Понедельник, 17.09.2012, 21:05 | Сообщение # 22 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| Планеты земной группы
В атмосферах Земли, Венеры, Марса можно обнаружить углекислый газ, водяные пары, азот.
Схож и химический состав планет первой четверки. Они, в основном, состоят из соединений кремния (силикатов) и железа. Остальные элементы, конечно, тоже присутствуют, но их относительно немного.
Юпитер и Сатурн, их атмосферы состоят из легких элементов: водорода и гелия. Уран и Нептун в значительной степени содержат в себе метан, аммиак, воду и другие не слишком тяжелые соединения.
ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Понедельник, 10.06.2013, 16:30 | Сообщение # 23 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ЗАДАЧИХХI Всеукраинского Турнира Юных Химиков
(2013/2014 учебный год)
http://www.kharkivosvita.net.ua/files/problemsXXI_r.pdf
1. «Котёл алхимика». В 1986 году немецкий художник Зигмар Польке поразил зрите-лей Венецианской биеннале своей работой. На стене павильона специальной смесью он на-рисовал абстрактную композицию, цвета которой изменялись в зависимости от освещения, времени суток, влажности и температуры воздуха, а также от количества зрителей в поме-щении. За эту работу, которую он назвал «Котёл алхимика», жюри присудило ему «Золотого льва» в области живописи. Попробуйте раскрыть секрет красок художника.
2. «Периодическая система». На момент открытия Периодического закона было из-вестно 63 химических элемента. В наше время известно уже 118. Оцените максимальный «размер» Периодической системы химических элементов. Какие гипотезы и теории можно использовать для оценки максимально возможного количества химических элементов?
3. «Невидимые чернила». Предложите вещество или смесь со свойствами «невиди-мых чернил» и с возможностью обратимо изменять свою «видимость» при воздействии оп-ределённых факторов. Оцените возможность практического применения таких чернил.
4. «Автозаправка». У вас возникло подозрение, что сотрудники автозаправки добав-ляют в бензин различные дешёвые примеси для увеличения его объёма. Возможно ли, ис-пользуя доступные бытовые вещества, проверить свои подозрения? Предложите методику обнаружения недопустимых примесей в топливе с помощью химических реакций без ис-пользования аналитических приборов.
5. «Нетоксичные технологии». В последнее время мировые производители стараются максимально избежать использования токсичных веществ (свинца, ртути и других) в своих изделиях. Какие токсичные, ядовитые или вредные вещества до сих пор используются в со-временных технологиях? Предложите способы их замены менее вредными. Оцените досто-инства и недостатки ваших новых материалов или устройств по сравнению с традиционны-ми.
6. «Защита для Пушкина». Предложите индивидуальное соединение или смесь для обеспечения защиты металлических скульптурных композиций от внешнего пагубного воз-действия. Опишите основные критерии, которым должен соответствовать такой препарат.
7. «Картофельная батарея». В компьютерной игре «Portal 2» злобный компьютер ра-ботает от «картофельной» батареи, сделанной из картофелины с воткнутыми в неё цинко-вой и медной пластинками. Оцените ЭДС и силу тока, которую может обеспечить одна та-кая «картофельная» батарея. Как будет влиять на эти параметры степень зрелости картофе-ля? Изменится ли эффективность такой батареи при термической обработке картофелины? Оцените параметры батарей, изготовленных на основе ряда других фруктов и овощей, и выберите наиболее эффективный съедобный источник тока. Какие физико-химические ха-рактеристики плодов и клубней имеют первостепенное значение для качества батареи?
8. «Мицеллы». Образование мицелл – уникальная способность растворов ПАВ. Опи-
шите зависимость между строением молекул ПАВ и их поверхностной активностью. Какие
способы модификации современных ПАВ вы можете предложить для создания веществ с
максимальной поверхностной активностью?
9. «Усилитель света». Предложите физико-химическую систему, которая после облу-
чения монохроматическим светом излучала бы свет с меньшей длиной волны.
10. «Растворитель». Многие химические реакции происходят в растворах. Каким об-
разом свойства растворителя влияют на протекание химических реакций? Может ли смена
растворителя, при неизменных остальных параметрах, изменить направление или скорость
химических реакций с участием органических веществ? Возможно ли изменением раствори-
теля регулировать выход продукта реакции от теоретически возможного?
11. «Что-то крупное издохло…». Как правило, органические соединения, содержа-
щие гетероатомы, имеют неприятный запах. Предположите, при каком соотношении числа
атомов углерода к числу гетероатомов в молекуле запах будет наиболее сильным? Как ин-
тенсивность запаха зависит от типа гетероатома? Рассмотрите на примере соединений, со-
держащих азот, фосфор, серу и селен.
12. «Горячий лёд». Под воздействием сверхвысокого давления свойства некоторых
веществ существенно изменяются. Таким способом учёным удалось получить чёрный фос-
фор, металлический водород, лёд, который не плавится даже в кипятке. Поясните причины
изменений физических и химических свойств в подобных условиях, и предположите воз-
можность таких изменений у других веществ.
13. «Антимиры». При контакте материи с антиматерией происходит их аннигиляция
с выделением огромного количества энергии. Так ли всё драматично в мире биоорганичес-
кой химии? Представьте, что всё живое на нашей планете, кроме человека, под действием
некоей силы вдруг превратилось в своих антиподов, белки которых состоят из остатков
D-аминокислот. Предположите последствия такой модификации. Возможно ли приспособ-
ление организма человека к новым условиям?
14. «Монгольфьер». Воздушный шарик увеличивает свой объём при нагревании газа
внутри его оболочки. Предложите вещество с молекулами приблизительно сферической
формы, которые могли бы обратимо существенно увеличивать свой объём при повышении
температуры или при изменении других условий.
15. «Молекулярная липучка». Предложите наноразмерную систему, которая сможет
обратимо склеивать две поверхности за счёт контакта типа «петля – крючок». Обсудите ве-
щества, которые можно для этого использовать, а также взаимодействия, благодаря которым
возможно склеивание поверхностей. Предположите условия, которые необходимо изменять
для осуществления склеивания и расклеивания поверхностей.
Авторы: А. В. Волянская, А. В. Григорович, А. О. Дорошенко, А. А. Зильберман,
Н. С. Калиберда, В. Е. Крыжановский, И. М. Курилишин, А. Ю. Ляпунов,
А. С. Ляшук, Д. И. Проц, Н. Н. Пустовойченко, Ю. И. Смаглюк, И. Б. Щербаков.
ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Воскресенье, 01.09.2013, 13:53 | Сообщение # 24 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| Департамент освітиХарківської міської радиНауково-методичний педагогічний центр Задачі ХІ міського турніру юних хіміків(2013/2014 навчальний рік) 1. «Котелалхіміка». В 1986 році німецький художник Зіґмар Польке вразив глядачівВенеційської бієнале своєю роботою. На стіні павільйону спеціальною сумішшю він намалював абстрактну композицію, кольори якої змінювалися взалежності від освітлення, пори доби, вологості та температури повітря, а також
від кількості глядачів в приміщенні. За цю роботу, яку він назвав «Котел
алхіміка», журі присудило йому «Золотого лева» в галузі живопису. Спробуйте
розкрити секрет фарб художника. 2. «Періодичнасистема». На момент відкриття Періодичного закону було відомо 63 хімічнихелемента. У наш час відомо вже 118. Оцініть максимальний «розмір» Періодичної
системи хімічних елементів. Які гіпотези та теорії можна використовувати дляоцінки максимально можливої кількості хімічних елементів? 3. «Невидимечорнило». Запропонуйте речовину або суміш з властивостями «невидимих чорнил» і з можливістю оборотно змінюватисвою «видимість» під впливом певних чинників. Оцініть можливість практичного
застосування таких чорнил. 4. «Автозаправка».У вас виникла підозра, що працівники автозаправки додають у бензин різні дешеві
домішки для збільшення його об’єму. Чи можливо, використовуючи доступні
побутові речовини, перевірити свої підозри? Запропонуйте методику виявлення
неприпустимих домішок у паливі за допомогою хімічних реакцій без використання
аналітичних приладів. 5. «Нетоксичнітехнології». В останні роки світові виробники намагаються максимальноуникнути використання токсичних речовин (свинцю, ртуті й інших) у своїх виробах. Які токсичні, отруйні чи шкідливіречовини досі використовуються в сучасних технологіях? Запропонуйте способи
їхньої заміни менш шкідливими. Оцініть переваги та недоліки ваших нових
матеріалів чи пристроїв у порівнянні з традиційними. 6. «Захист дляПушкіна». Запропонуйте індивідуальну сполуку або суміш для забезпеченнязахисту металевих скульптурних композицій від зовнішнього згубного впливу. Опишіть основні критерії,яким має відповідати такий препарат. 7. «Картоплянабатарея». У комп’ютерній грі «Portal 2» злобний комп’ютер працює відкартопляної батареї, що зроблена з картоплини зі встромленими в неї цинковою та
мідною пластинами. Оцініть ЕРС та силу струму, що може забезпечити одна така
«картопляна» батарея. Як впливатиме на ці параметри ступінь зрілості картоплі?
Чи зміниться ефективність такої батареї при термічній обробці картоплини?
Оцініть параметри батарей, виготовлених на основі ряду інших фруктів та овочів,
та оберіть найефективніше їстівне джерело струму. Які фізико-хімічні характеристики плодів табульб мають першорядне значення для якості батареї? 8. «Міцели».Утворення міцел – унікальна здатність розчинів ПАР. Опишіть залежність між
будовою молекул ПАР та їхньою поверхневою активністю. Які способи модифікації
сучасних ПАР ви можете запропонувати для створення речовин з максимальною
поверхневою активністю? 9. «Посилювачсвітла». Запропонуйте фізико-хімічну систему, що після опроміненнямонохроматичним світлом випромінювала б світло з меншою довжиною хвилі. 10. «Розчинник».Багато хімічних реакцій відбуваються у розчинах. Яким чином властивості розчинника
впливають на перебіг хімічних реакцій? Чи може зміна розчинника, при інших
сталих параметрах, змінити напрям або швидкість хімічних реакцій за участю
органічних речовин? Чи можливо зміною розчинника регулювати вихід продукту
реакції від теоретично можливого?(http://chemturnir.org.ua/
ЗРИ В КОРЕНЬ
|
|
|
| |
| ovsanka | Дата: Понедельник, 05.05.2014, 16:00 | Сообщение # 25 |
 Я здесь прописан(а)
Группа: Модераторы
Сообщений: 2394
Статус: Offline
| МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЗАДАЧІ
ХХІІ Всеукраїнського Турніру Юних Хіміків
(2014/2015 навчальний рік)
Автори: О. О. Бородін, В. К. Бухтіяров, А. В. Волянська, О. В. Григорович, І. О. Гуцкалов,
О. П. Демчук, М. С. Каліберда, О. С. Кобякін, В. Є. Крижановський, О. Ю. Ляпунов,
В. Г. Пивоваренко, В. М. Сомов, С. В. Супрунович, О. В. Хаврюченко.
http://chemturnir.org.ua/
1. «Природодемонстрація». Підберіть набір з десяти хімічних дослідів, що демонстрували б природні явища, зокрема, дощ, проростання насіння, іржавіння тощо, які можна було викорис-товувати при поясненні цих явищ на уроках у молодшій школі.
2. «Перші тридцять». Як би змінилося життя на Землі, якщо б на нашій планеті існували тільки хімічні елементи з порядковими номерами у Періодичній системі Д. І. Менделєєва не біль-ше за 30? Опишіть основні зміни у складі та функціонуванні атмосфери, гідросфери та літосфе-ри. В який спосіб ми би мали організовувати виробництво найважливіших промислових продук-тів та наш побут? Як змінилася б історія розвитку нашої цивілізації та науки?
3. «Неприродний природний газ». Останнім часом поширена думка, що природний газ, який централізовано отримують споживачі, «розбавляють», тобто знижують його питому тепло-творну здатність. Запропонуйте хімічний спосіб перевірки «розбавлення» природного газу. Які речовини можуть бути використані для «розбавлення»? Як хімічними методами можна визначи-ти речовину, що використана для «розбавлення»?
4. «Фізичні методи дослідження». При вивченні хімії в школі ми дуже часто оперуємо ха-рактеристиками речовин, зокрема, довжина зв’язку, енергія йонізації, полярність молекул, сту-пінь дисоціації тощо, що визначаються за допомогою певних фізичних методів дослідження. На-ведіть обов’язкові для вивчення в шкільному курсі властивості елементів, атомів, молекул, речо-вин та їхніх сумішей, що неможливо визначити без використання фізичних методів дослідження. Коротко опишіть способи визначення цих властивостей. На підставі цього обґрунтуйте які фізич-ні методи дослідження потрібно вивчати в шкільному курсі хімії.
5. «Ігри з перчатками». Часто в хімічних лабораторіях грайливі експериментатори вико-ристовують не за призначенням латексні перчатки. Наприклад, в неї наливають який-небудь роз-чинник, однак, з часом перчатка починає пропускати розчинник або розривається. Оцініть час, протягом якого латексна перчатка зможе утримувати певний розчинник об’ємом 0,5 л без проті-кання. Побудуйте ряд з не менш як 10 розчинників за часом утримування розчинника у перчатці. Чи можливо побудувати математичну модель для розрахунку часу утримування розчинника пер-чаткою?
6. «Промінь світла у темному царстві». Запропонуйте склад гомогенної закритої системи, що може за рахунок хімічних процесів протягом не менше 5 хвилин безперервно генерувати біле світло високої інтенсивності. Опишіть процеси, що відбуваються в цій системі. Наведіть розрахун-ки, що теоретично обґрунтують високу інтенсивність та тривалість світіння запропонованої сис-теми.
7. «Космічна атмосфера». В результаті аварії на космічній станції стався витік повітря; до усунення пошкодження його запаси сягнули критичної кількості, якої космонавтам вистачить на одну добу. Запропонуйте спосіб добування придатної для дихання газової суміші з викорис-танням тільки устаткування та матеріалів, наявних на космічній станції.
8. «Надпровідний розчин». Опишіть, яким чином на електропровідність розчинів впли-
вають температура, природа розчинника, природа розчиненої речовини та її концентрація. За-
пропонуйте та обґрунтуйте склад рідкого розчину з найбільшою електропровідністю.
9. «Срібне дзеркало». Реакція срібного дзеркала є однією з найбільш видовищних. Пояс-
ніть механізм утворення срібного покриття на стінках посуду в ході цієї реакції. Яких вимог до
посуду та умов реакції необхідно дотримуватися, щоб отримати саме дзеркальне покриття, а не
колоїдне срібло? Запропонуйте та продемонструйте (за можливості) декілька експериментів,
в яких можна отримати аналогічні дзеркальні покриття з інших матеріалів на склі.
10. «Антизапрівач». Запропонуйте безпечну суміш або індивідуальну речовину, що під-
ходить для захисту автомобільного скла від запотівання. Обговоріть умови практичного застосу-
вання цього засобу та принцип його дії.
11. «Майже хромова суміш». Одним з найефективніших засобів для миття хімічного посу-
ду в лабораторії є високотоксична хромова суміш. Доступні альтернативи – нохромікс, суміш
сульфатної кислоти з гідроген пероксидом, царська вода – значно менш токсичні, але виявляють
низьку стабільність і незручні у використанні. Запропонуйте ефективний безпечний засіб для
миття хімічного посуду, що буде поєднувати в собі найкращі властивості хромової суміші та низь-
ку токсичність.
12. «Незвичайний звук». Окрім температури, тиску, природи розчинника й інших факто-
рів на перебіг хімічної реакції може впливати звук. Наведіть декілька прикладів реакцій, що іні-
ціюються звуком. Поясніть фізико-хімічну природу цього явища. Обговоріть можливість зміни
швидкості і напряму реакції при використанні звуку різної частоти та інтенсивності.
13. «Що написано пером…». На банківських картках обов’язково присутня смужка для
особистого підпису власника картки, властивості поверхні якої практично не дозволяють стерти
надпис на смужці. Запропонуйте речовину або суміш, якою можна обробити звичайний папір
для того, щоб написи, зроблені на ньому звичайним олівцем після такої обробки, неможливо бу-
ло б стерти. Обговоріть можливість обробки такого паперу з написом іншою речовиною, після
чого з’явилася б можливість стерти надпис.
14. «Кислотність». Часто вченим потрібно порівнювати кислотно-основні властивості тих
чи інших органічних сполук. Запропонуйте характеристики, використовуючи які можна порів-
нювати протолітичні властивості органічних сполук. Яким методом можна теоретично або прак-
тично визначити константи кислотності або основності для цих сполук? Проілюструйте свої мір-
кування на прикладах якомога більшого числа органічних сполук з різними функціональними
групами.
15. «Diels versus Alder». Реакції циклоприєднання дуже важливі в органічній хімії. Чи
можливі такі реакції для неорганічних речовин? Запропонуйте якомога більше аналогій реакції
циклоприєднання серед реакцій між неорганічними сполуками. У чому полягають спільні та від-
мінні риси реакцій циклоприєднання для органічних та неорганічних речовин?
ЗРИ В КОРЕНЬ
|
|
|
| |
|

